हेन्रीचे कायद्याचे सूत्र: हेन्रीचा कायदा अर्ज, सूत्र आणि नोट्स येथे तपासा.
हेन्रीच्या कायद्याचा वापर: रसायनशास्त्र हा विज्ञानाच्या विद्यार्थ्यांसाठी महत्त्वाचा विषय आहे आणि जर तुम्ही उच्च शिक्षणासाठी प्रवेश घ्यायचा असेल तर त्याची टक्केवारी विचारात घेतली जाते. रसायनशास्त्रातील विविध सूत्रे आणि रासायनिक समीकरणे आहेत जी विद्यार्थ्यांना शिकणे आणि समजणे कठीण आहे. असाच एक विषय म्हणजे हेन्रीचा कायदा. येथे आपण हेन्रीच्या कायद्याची व्युत्पत्ती, हेन्रीचा कायदा विद्राव्यता सूत्र, हेन्रीचा कायदा स्थिरांक आणि हेन्रीच्या कायद्याचा उपयोग यावर चर्चा करणार आहोत. यासह, आम्ही काही उदाहरणे दर्शवू जिथे तुम्ही हेन्रीचा कायदा वापरू शकता. हेन्रीच्या कायद्याच्या नोट्स वाचा.
हेन्रीचा कायदा काय आहे?
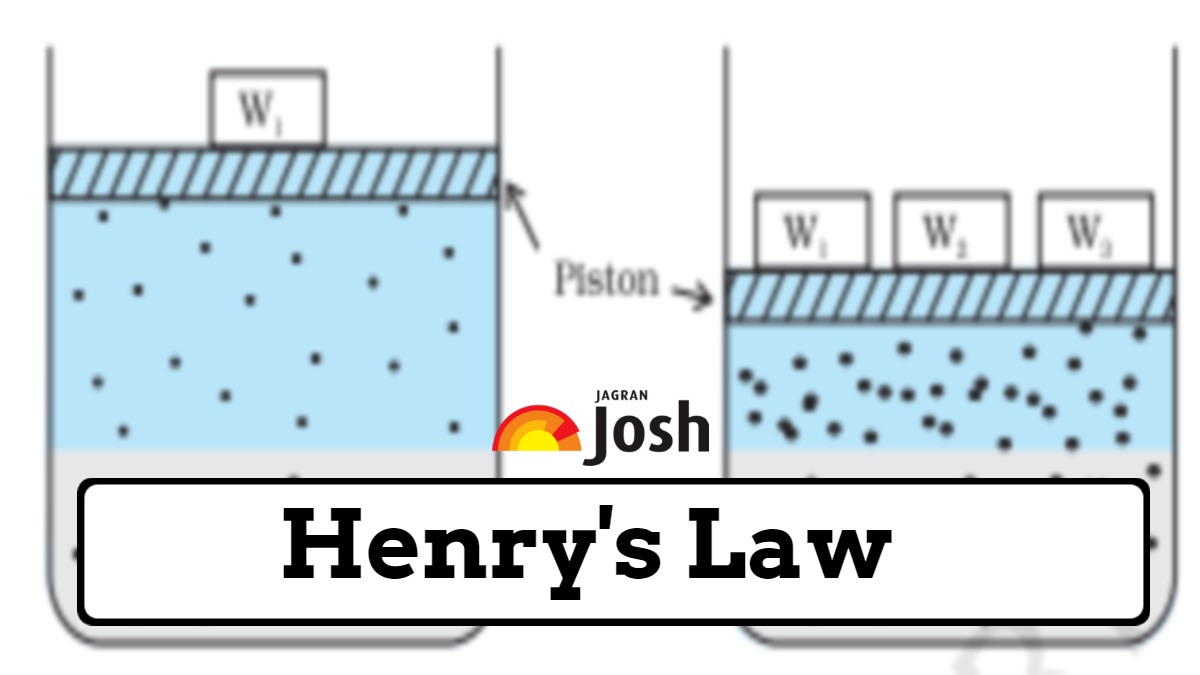
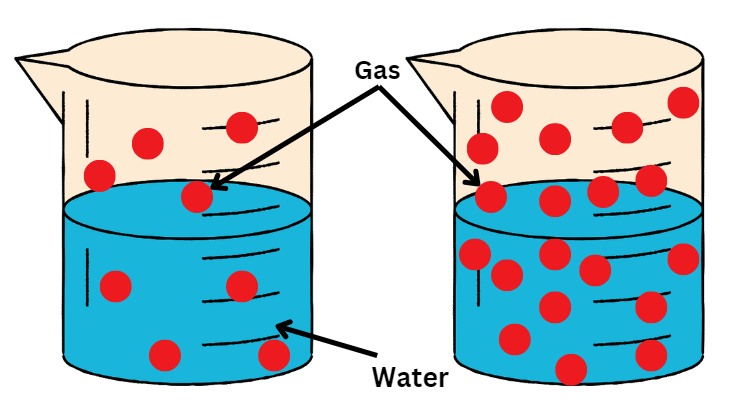
NCERT वर्ग 11 रसायनशास्त्र अध्याय 6 समतोल व्याख्येनुसार, हेन्रीचा नियम असे सांगतो की कोणत्याही तपमानावर सॉल्व्हेंटच्या दिलेल्या वस्तुमानात विरघळलेल्या वायूचे वस्तुमान हे विद्रावकाच्या वरच्या वायूच्या दाबाच्या प्रमाणात असते.. NCERT वर्ग 12 रसायनशास्त्र अध्याय 1 सोल्यूशन्सनुसार, हेन्रीचा नियम सांगतो की स्थिर तापमानात द्रवातील वायूची विद्राव्यता ही द्रव किंवा द्रावणाच्या पृष्ठभागावर असलेल्या वायूच्या आंशिक दाबाशी थेट प्रमाणात असते..
या दोन्ही व्याख्या समान आहेत आणि म्हणतात की जेव्हा तापमान स्थिर असते, तेव्हा द्रावणात विरघळलेल्या वायूचे प्रमाण किंवा वस्तुमान द्रवाच्या वर असलेल्या त्या वायूच्या आंशिक दाबाशी थेट प्रमाणात असते.
हेन्रीचा कायदा विद्राव्यता सूत्र
जर ‘P’ हा दाब असेल आणि ‘C’ हा वायूचे प्रमाण असेल तर
P∝C
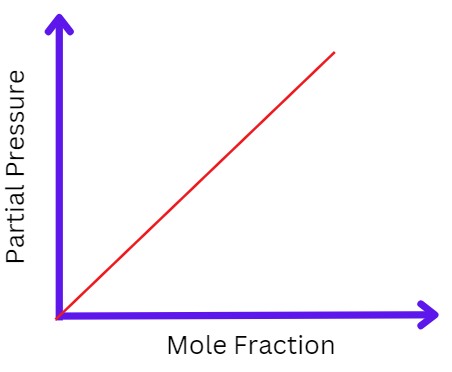
काढुन टाकणे ∝ आम्ही एक स्थिर ठेवू शकतो केएच, आता सूत्रे बनली आहेत;
पी = केएचसी
केएच हेन्रीचा नियम स्थिर आहे.
NCERT च्या पाठ्यपुस्तकानुसार ‘C’ ची जागा ‘𝓧’ ने घेतली जाऊ शकते‘ जो वायूचा तीळ अंश दर्शवतो. आता सूत्राची अशी पुनर्रचना केली जाऊ शकते;
पी = केएच𝓧
हेन्रीचा स्थिर नियम
हेन्रीचा नियम स्थिरांक K द्वारे दर्शविला जातोएच आणि याचा परिणाम होतो:
- वायूचे स्वरूप
- सॉल्व्हेंटचे स्वरूप
- तापमान
- दाब
यामुळे, वेगवेगळ्या वायूंमध्ये भिन्न केएच.
हेन्रीच्या कायद्याचे अनुप्रयोग
1. कार्बोनेटेड पेयेचे उत्पादन
NCERT भाषेत’सोडा पाण्याची बाटली पाण्यामध्ये विद्राव्यता जास्त असताना गॅसच्या दाबाने बंद केली जाते. बाटली उघडल्याबरोबर, काही विरघळलेला कार्बन डाय ऑक्साईड वायू कमी दाबासाठी आवश्यक असलेल्या नवीन समतोल स्थितीपर्यंत पोचतो, म्हणजे त्याचे वातावरणातील आंशिक दाब. अशा प्रकारे बाटलीतील सोडा पाणी काही काळ हवेत उघडे ठेवल्यास ते ‘सपाट’ होते.’
याचा अर्थ असा की कार्बोनेटेड पेयांमध्ये, कार्बन डायऑक्साइडचे प्रमाण सामान्यपेक्षा जास्त असते कारण बाटल्या वातावरणाच्या दाबापेक्षा जास्त दाबाने पॅक केल्या जातात. अशा प्रकारे, आपण बाटल्या उघडल्याबरोबर, समतोल राखण्यासाठी कार्बोनेटेड पेयातून गॅस बाहेर पडतो.
2. रक्तातील ऑक्सिजनची पातळी राखणे
रक्तामध्ये, ऊती आणि पेशींमध्ये जाण्यासाठी ऑक्सिजनची एकाग्रता जास्त असणे आवश्यक आहे. सेल झिल्ली ओलांडून वायूचे रेणू उच्च आंशिक दाबापासून कमी आंशिक दाबाकडे जातात. अशा प्रकारे, जेव्हा रक्तामध्ये ऑक्सिजन वायूचा आंशिक दाब जास्त असतो, तेव्हा पेशी आणि ऊतींमध्ये ऑक्सिजन रेणूंचे प्रमाण वाढते आणि त्याउलट.
हेन्रीच्या कायद्याच्या मर्यादा
1. जेव्हा प्रणालीचे रेणू समतोल स्थितीत असतात तेव्हा हा कायदा लागू होतो.
2. सॉल्व्हेंट आणि गॅस रेणूंमधील प्रतिक्रिया दरम्यान कायदा लागू होत नाही.
3. जेव्हा वायू अत्यंत उच्च दाबाखाली ठेवल्या जातात तेव्हा हा कायदा लागू होत नाही.
हेन्रीच्या कायद्याच्या प्रश्नांची उदाहरणे सोडवली
Q1. जर एन2 वायू पाण्यामधून 293 K वर फुगवला जातो, 1 लिटर पाण्यात N2 वायूचे किती मिलीमोल विरघळेल? गृहीत धरा की N2 0.987 बारचा आंशिक दबाव टाकतो. हेन्रीचा नियम N साठी स्थिरांक दिलेला आहे2 293 K वर 76.48 kbar आहे.
सोल. वायूची विद्राव्यता जलीय द्रावणातील तीळ अंशाशी संबंधित आहे.
द्रावणातील वायूचा तीळ अंश हेन्रीचा नियम लागू करून मोजला जातो. अशा प्रकारे:
x (नायट्रोजन) = p(नायट्रोजन)/Kएच = ०.९८७बार/७६,४८० बार = १.२९ × १०-५
1 लिटर पाण्यात 55.5 mol असते, म्हणून जर n दर्शवितो
N च्या moles ची संख्या2 उपाय मध्ये,
x (नायट्रोजन) = n mol/n mol + 55.5 mol = n/ 55.5 = 1.29 × 10-५
(n भाजकात < < 55.5 असल्याने दुर्लक्षित आहे)
अशा प्रकारे n = 1.29 × 10-५ × ५५.५ मोल
= 7.16 × 10-4 मोल
= 7.16×10 mol × 1000 mmol/1 mol
= 0.716 mmol
Q2. 293 के तापमानात पाण्यातील वायू ऑक्सिजनची विद्राव्यता शोधा जेव्हा O द्वारे आंशिक दाब दिला जातो.2 1 बार आहे. (दिलेले: O साठी kH2 34840 bar.L.mol-1)
सोल. हेन्रीचा नियम P = kएच x C
बदली, केएच = 34840 bar.L.mol-1 आणि P = 1 बार, समीकरण बनते
C = 1/34840 mol.L-1 = 2.87 x 10-5 mol/L
अशा प्रकारे, दिलेल्या परिस्थितीत पाण्यात ऑक्सिजनची विद्राव्यता 2.87 x 10 आहे.-5 एम.
हे देखील वाचा: